Sistemas vegetales
Página : 63
Embriogénesis somática: una herramienta biotecnológica para la propagación in vitro de guayaba
Daniel Martin
Escuela Socialista de Agricultura Tropical, Instituto Nacional de Investigaciones Agrícolas. Avenida Universidad vía el Limón, edificio INIA. Maracay. Aragua. Venezuela. CP 2105. e-mail: danielmartin390@gmail.com
INTRODUCCIÓN
La guayaba (Psidium guajava L.), también conocida como la »fruta de los pobres» o la »manzana de los trópicos». Es originaria de la América Tropical Continental, se puede encontrar silvestre y cultivada en todas las regiones tropicales y subtropicales de Centroamérica, América del Sur, parte de México, entre otras. Desde finales del siglo XX, la producción comercial de guayaba se ha extendido a diversas regiones del mundo. Se destacan países como India, Sudáfrica, Pakistán, Estados Unidos, Australia, Filipinas, Venezuela, Brasil, México, Cuba, Egipto, Tailandia, Indonesia y Colombia, los cuales son los principales productores (Rai et al., 2010a; MPPAT, 2011).
La guayaba es una fruta muy popular tanto para el consumo fresco como para la obtención de productos procesados como jugos, néctares, concentrados, jaleas, bocadillos, relleno para dulces, etc. (Kessel, 2008). Representa uno de los frutales con grandes perspectivas de explotación, debido a las características nutricionales y organolépticas de su fruto, a su uso en la agroindustria y en la medicina natural, por su versatilidad para adaptarse a diferentes condiciones edafoclimáticas y por su aceptación y demanda en los mercados nacionales e internacionales (Vilchez et al., 2002).
En cuanto su valor nutricional, la guayaba destaca por las altas concentraciones vitaminas A, B y C, al igual que su importante contenido de fibra dietética, azúcares, taninos, flavonoides, carotenoides, lectinas, saponinas, fenoles y triterpenos. Por otro lado, entre las propiedades medicinales que se le atribuyen, se puede mencionar la actividad antibacteriana, antidiarreica, antiamebiana y antiespasmódica, así como también su efecto antiinflamatorio, expectorante y sedante (Biswas et al., 2007; Capote et al., 2009; Rai et al., 2009). Además, la alta concentración de pectina en la fruta puede jugar un papel significativo en la reducción del colesterol y por lo tanto en la disminución del riesgo por enfermedades cardiovasculares (Rai et al., 2010a; Patel et al., 2015).
Por otro lado, aunque la morfología de la flor de la guayaba favorece la autopolinización, se reconoce como una especie alógama que se cruza de manera natural con otras variedades (Lozano et al., 2002). Esto, unido a la propagación por semillas desde los inicios de su domesticación, ha generado poblaciones heterocigóticas que pueden ser usadas en los programas para el mejoramiento genético (Fernández y Pérez, 2015). Sin embargo, la propagación sexual se ha venido practicando durante años por los productores dentro de los sistemas producción comercial, lo que ha generado variabilidad en la descendencia y demoras significativas en la producción. Estas que constituyen desventajas sustanciales que limitan su empleo como método de propagación para esta especie (Ocampo y Núñez, 2007; MPPAT, 2011).
Las técnicas convencionales de propagación asexual aplicadas en la guayaba, han sido poco eficientes y han dificultado la masificación de este rubro a niveles deseables, asociados principalmente a que presentan un largo período juvenil que retrasa la producción comercial de frutas, aunado a la autoincompatibilidad y la naturaleza heterocigota de la especie (Rai et al., 2010a).
En este sentido, las tendencias mundiales referidas a la propagación de guayaba, abren un espacio cada vez mayor al uso de técnicas biotecnológicas, donde lograr plantas completas a partir de células o tejidos se considera una herramienta fundamental de la biotecnología vegetal. Disponer de técnicas que permitan la regeneración de plantas, es imprescindible para que la clonación, el saneamiento, la crioconservación de material vegetal o la transformación genética, se conviertan en biotecnologías de aplicación para este rubro (Celestino et al., 2005).
Por lo tanto, el establecimiento y estandarización de protocolos para la regeneración de plantas de guayaba in vitro, se considera fundamental para su propagación y pueden facilitar tecnologías para el mejoramiento genético. De esta manera, el cultivo de tejidos se presenta como una herramienta, que en combinación con los métodos convencionales de propagación y de mejoramiento genético de la guayaba, puede desempeñar un papel fundamental para el desarrollo, la calidad y rendimientos de este frutal (Celestino et al., 2005; Tariq et al., 2008).
Como ejemplo de ello, Biswas et al. (2007) usaron técnicas de cultivo in vitro como herramientas para el mejoramiento genético en guayaba. Estos autores obtuvieron plantas tolerantes a bajas temperaturas, mediante la transferencia de los genes cbf1, cbf2 y cbf3 (relacionados con la tolerancia al frío), mediante la transformación genética mediada por Agrobacterium tumefaciens. Por otro lado, Rai et al. (2010b) mediante embriogénesis somática, lograron la regeneración de plantas a partir de embriones somáticos sometidos a condiciones de estrés salino. También Kamle et al. (2012) demostraron que la combinación de embriogénesis somática y el filtrado de cultivo de Fusarium sp., puede emplearse como estrategia para la selección in vitro frente a la enfermedad de la marchitez de la guayaba.
De esta manera, en un amplio número de especies leñosas se han realizado investigaciones para obtener plantas in vitro por medio de técnicas biotecnológicas como la embriogénesis somática (Ocampo y Núñez, 2007) que es un proceso por el cual se obtiene una estructura similar al embrión cigótico sin que medie la fertilización de los gametos (Tisserat et al., 1979; Kamle et al., 2011). Teóricamente, este proceso es considerado como el más eficiente para la regeneración masiva de plantas in vitro debido a la naturaleza bipolar del embrión, la posibilidad de automatizar todo el proceso productivo, los altos coeficientes de multiplicación en cortos períodos de tiempo y la posibilidad de encapsular estas estructuras y obtener semillas artificiales (Freire, 2003). Por esta vía de regeneración se obtienen auténticas semillas somáticas que tienen su origen en células somáticas, las cuales se “reprograman” y siguen un patrón de desarrollo idéntico al del embrión de origen cigótico (Celestino et al., 2005).
Partiendo de las consideraciones anteriores, el objetivo de este trabajo fue presentar una revisión de literatura científica sobre el uso de la embriogénesis somática como una técnica biotecnológica para la propagación in vitro de guayaba.
LA EMBRIOGÉNESIS SOMÁTICA Y LA REGENERACIÓN DE PLANTAS
La embriogénesis somática, es posible, ya que implícitamente toda célula somática vegetal tiene la capacidad de desarrollarse en un embrión (totipotencia) a partir de la manipulación de condiciones de cultivo y la aplicación de sustancias reguladoras de crecimiento (Freire, 2003). Las primeras evidencias de que las plantas podían producir embriones somáticos in vitro, fueron presentadas por Steward et al. (1958) y Reinert (1959), lo que ya es un hecho bien establecido en más de 200 especies de interés agronómico (Vilchez, 2016).
La embriogénesis somática, es la vía de desarrollo celular donde células somáticas dan lugar a organizaciones similares a embriones cigóticos sin que medie la fusión de los gametos, o sea, una organización bipolar que no tiene conexión vascular con el tejido parental (von Arnold et al., 2002).
De esta manera, las células somáticas pueden generar plantas completas, aunque al no ser la célula inicial producto de un proceso de recombinación y fusión de gametos, se conserva íntegramente el genotipo de la planta donante (clonación). La composición de las células, tejidos y órganos de alta respuesta a las señales específicas de las condiciones químicas y ambientales, pueden ser el punto de partida para nuevos programas de desarrollo referidos a la inducción de la embriogénesis somática (Freire, 2003).
EMBRIOGÉNESIS SOMÁTICA EN GUAYABA
La inducción de la embriogénesis somática, consiste en la terminación del patrón de expresión de los genes presentes en el tejido del explante, siendo esto reemplazado con un programa de expresión de genes o gen de la embriogénesis en aquellas células del tejido del explante que pudieran dar lugar a embriones somáticos (Freire, 2003).
Investigadores como Ramírez y Salazar (1998), Vilchez et al. (2002), Chandra et al. (2004), Gómez et al. (2005), Singh et al. (2007), Rai et al. (2007), Ferreira y Yoshimitsu (2009), Akhtar (2010), Kamle et al. (2012), Vilchez (2016) y Martin (2017) han logrado con éxito la embriogénesis somática en diferentes cultivares de guayaba (Tabla 1).
El proceso para la inducción de embriogénesis somática en guayaba, se ha visto afectado por varios factores. Entre ellos se encuentra la naturaleza del explante y su edad fisiológica, la duración del tratamiento con auxina, la interacción del efecto de la auxina y la sacarosa, el genotipo y el efecto de los diferentes reguladores de crecimiento y sus combinaciones (Akhtar et al., 2000; Jaiswal y Jaiswal, 2005; Rai et al., 2007).
En más de una ocasión se han utilizado segmentos de hojas como explante, cuyo potencial morfogenético ha sido capaz de regenerar plantas en especies leñosas por la vía de la embriogénesis somática. En el caso de guayaba, los intentos por llevar a cabo la formación de callos y la regeneración de tejido embriogénico a partir de segmentos de hojas (tomadas de plantas de campo y en condiciones de libre crecimiento) han fallado, fundamentalmente a causa de la alta fenolización y la contaminación por microorganismos, lo que impide la viabilidad de los explantes (Laffitte et al., 2004).
Por otro lado, el uso de embriones cigóticos inmaduros ha demostrado ser un tejido eficaz para la regeneración de especies recalcitrantes de frutas tropicales, ya que están compuestos por células que poseen competencia embriogénica o PEDCs (del inglés: preembryogenic determined cells), que pueden ser fácilmente inducidas a seguir la vía de desarrollo embriogénico (Sharp et al., 1980; Rai et al., 2010a; Kamle et al., 2016). También, han sido probados como explantes nudos, entrenudos, mesocarpo de frutos inmaduros, hipocótilo, pétalos y anteras (Chandra et al., 2004; Singh et al., 2007; Biswas et al., 2007).
En cuanto a los medios de cultivo, se han venido utilizando varios, donde en la mayoría de los casos han sugerido el uso del propuesto por Murashige y Skoog (1962) (MS) o de sus derivados (Chandra et al., 2004; Rai et al., 2010a, Vilchez, 2016; Martin, 2017). Sin embargo, en la investigación presentada por Biswas et al. (2007) estos autores informaron que no obtuvieron embriones somáticos en medios de cultivo MS ni B5 (Gamborg et al., 1968), por lo que utilizaron GSEM (del inglés: guava somatic embryogenesis medium), que es una versión modificada del medio de cultivo MS.
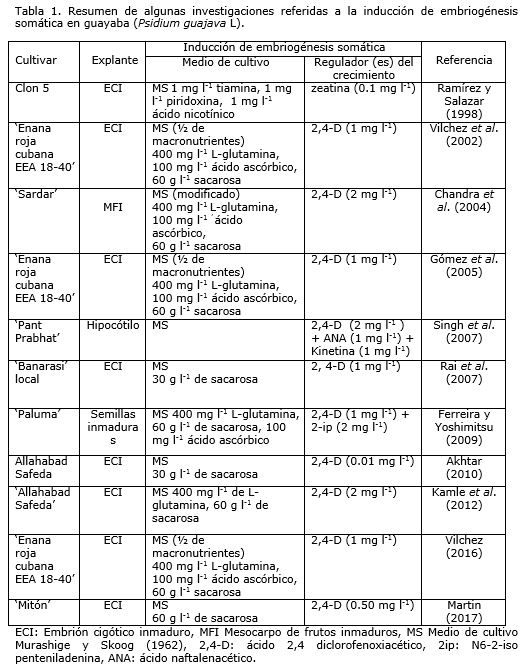
Todos los medios de cultivo contienen altos niveles de sales de amonio y nitrato, los cuales desempeñan un papel esencial para la inducción de la embriogénesis somática (Akhtar et al., 2000). También, el uso de nitrógeno en forma de aminoácidos como L-glutamina, y compuestos orgánicos como el ácido ascórbico, han demostrado ser efectivos en la inducción de la embriogénesis somática en guayaba (Chandra et al., 2004; Gómez et al., 2005; Biswas et al., 2007).
En general, el proceso de inducción está mediado por auxinas, en particular el ácido 2,4 diclorofenoxiacético (2,4-D), el cual ha sido referido en la mayoría de las investigaciones donde la embriogénesis somática en guayaba se ha logrado con éxito (Gómez et al., 2005; Rai et al., 2007; Kamle et al., 2012; Vilchez, 2016; Martin, 2017). Otras auxinas, como el ácido indolacético (AIA), ácido indolbutírico (AIB), ácido naftalenacético (ANA) y citoquininas, como benzilaminopurina (BAP), kinetina (Kin) y tidiazuron (TDZ) solas o en combinación con 2,4-D han demostrado ser menos eficaces que el 2,4-D por si solo (Akhtar et al., 2000; Jaiswal y Jaiswal, 2005).
Otros investigadores como Ramírez y Salazar (1998) cultivaron in vitro embriones cigóticos inmaduros de guayaba provenientes de frutos de plantas adultas cultivadas en el campo (clon 5). Evaluaron el efecto de diferentes citocininas, donde el mejor tratamiento para formar embriones somáticos fue el que contenía 0.1 mg l-1 de zeatina. Sin embargo, afirmaron que la presencia de citocininas en el medio de cultivo no fue necesaria para la formación de callo, aunque sí se requirió para inducir la formación de los embriones somáticos e incrementar el porcentaje de los mismos en los explantes.
Por otro lado, con el propósito de inducir la embriogénesis somática a partir de embriones cigóticos en guayaba del cultivar ‘Enana Roja Cubana EEA 18-40’, Vilchez et al. (2002) estudiaron tres concentraciones de 2,4-D en medio de cultivo MS. Estos autores afirmaron que con 1.0 mg l-1 de 2,4-D es posible inducir la embriogénesis somática de forma indirecta y de baja frecuencia a partir de embriones cigóticos inmaduros. De la misma manera, Chandra et al. (2004) lograron formar embriones somáticos a partir de tejido inmaduro del mesocarpo de guayaba cv. ‘Sardar’ en medio de cultivo MS con 2.0 mg l-1 de 2,4-D, en este observaron un tejido embriogénico, translúcido y mucilaginoso, donde se diferenciaron claramente los pequeños embriones somáticos.
También Rai et al. (2007) con el objetivo de generar una metodología para la propagación in vitro en guayaba cv. ‘Banarasi’ mediante el uso de embriones cigóticos, lograron inducir la embriogénesis somática. Consiguieron la mayor cantidad de embriones somáticos en medio de cultivo MS con 0.10 mg l-1 de 2,4-D. De esta manera, también Concepción (2008) logró inducir embriogénesis somática indirecta en guayaba cv. ‘Enana Roja Cubana’ en medio de cultivo líquido, utilizando embriones cigóticos inmaduros como explante inicial. Para la formación del callo embriogénico evaluaron el efecto de diferentes concentraciones de 2,4-D, Picloram (4-amino-3,5,6- tricloropiridina-2-ácido carboxílico) y Dicamba (ácido 3,6-dicloro-2-metoxibenzoico) en el medio de cultivo para plantas leñosas (WPM).
Del mismo modo, Vilchez (2016) valoró el efecto de dos auxinas en la inducción de embriogénesis somática en embriones cigóticos inmaduros de guayaba cv. ‘Enana Roja Cubana 18-40’. El experimento factorial incluyó al 2,4-D y Dicamba a diferentes concentraciones. Se lograron los mejores resultados en cuanto a la formación de callo, callo embriogénico y masas proembriogénicas de 100%, 59.6% y 36.3% respectivamente, en medio de cultivo MS con 1.0 mg l-1 de 2,4-D.
Otro aspecto importante a considerar, es el tiempo de exposición del explante a los reguladores del crecimiento, lo que ha sido un factor determinante en la efectividad de la inducción y desarrollo de embriones somáticos. En la mayoría de los casos, la auxina solo es requerida para inducir la embriogénesis somática, ya que posteriormente puede actuar como inhibidor en el desarrollo de los embriones somáticos. Así lo demostraron Rai et al. (2007) cuando realizaron un experimento con embriones cigóticos inmaduros de guayaba cv. ‘Banarasi’. Los mejores resultados se obtuvieron cuando los explantes fueron expuestos durante 8 días a un medio de cultivo MS con 2,4-D (1 mg l-1). También, informaron que en los tratamientos de exposición continua al 2,4-D (durante 60 días), la diferenciación de los embriones somáticos solo llegó hasta la etapa más joven (torpedo).
Asimismo, Akhtar (2013b) informó que la frecuencia más alta de embriogénesis (68.8%) y de intensidad embriogénica (69.2%), así como las frecuencias de embriones somáticos tipo torpedo alargados y cortos (15% y 42.9% respectivamente), con la mayor eficiencia (27.5) fue alcanzada cuando los explantes fueron expuestos durante 8 días en medio de cultivo MS que contenía 0.5 mg l-1 de 2,4-D. Resultados más significativos fueron informados por Martin (2017) donde se establecieron condiciones para inducir embriogénesis somática directa y de alta frecuencia en guayaba cv. ‘Mitón’ a partir de embriones cigóticos inmaduros, valorando el tiempo de exposición del explante al 2,4-D y la concentración de esta auxina. Los valores más altos de la frecuencia (100%) y eficiencia embriogénica (71.8%), así los números más altos de embriones somáticos en sus diferentes estados de desarrollo (globular, corazón, torpedo y cotiledonal), se alcanzaron cuando los embriones cigóticos inmaduros fueron expuesto por 10 días a 0.5 mg l-1 de 2,4-D y luego se transfirieron a medio de cultivo libre de la auxina.
Por otro lado, Akhtar (2013a) evaluó el papel de la concentración exógena y endógena de las formas totales, libres, conjugadas y unidas de tres poliaminas; putrescina, espermidina y espermina en la regulación temporal de la embriogénesis somática en función de la concentración de 2,4-D. Sus resultados mostraron que las respuestas de la embriogénesis cambiaron gradualmente en relación al tiempo de exposición y a las concentraciones 2,4-D de 0.01 mg l-1 a 0.5 mg l-1. El tratamiento con el tiempo de exposición de 8 días y la concentración de 0.5 mg l-1 de 2,4-D presentó el mayor valor en cuanto la eficiencia de la embriogénesis somática (61.23), superando significativamente el valor de la eficiencia informada por Akhtar (2013b), lo que indica que la regulación temporal de la embriogénesis somática en guayaba por 2,4-D fue modulada por el metabolismo de las poliaminas.
También se ha informado que los carbohidratos desempeñan un papel importante en el desarrollo de las plantas, además de ser necesarios para el proceso de respiración, permite realizar las funciones para la síntesis de muchos compuestos (Gibson, 2000). En este sentido, para la lograr eficientemente la embriogénesis somática en guayaba, también se han probado varias fuentes de carbono. La investigación de Akhtar et al. (2000) permitió demostrar que los explantes no pueden utilizar o metabolizar todas las fuentes de carbono de manera eficiente, y por lo tanto esto se puede considerar como un factor limitante en los procesos de inducción y desarrollo de los embriones somáticos. Sin embargo, se ha informado que la sacarosa ha sido utilizada como la principal fuente de carbono para promover el proceso de embriogénesis somática en guayaba y que otras fuentes de carbono no son metabolizadas fácilmente por esta especie. Se ha referido su uso en los medios de cultivo en concentraciones que oscilan entre 3 y 6% (Gómez et al., 2005; Rai et al., 2007).
Embriogénesis secundaria
Un hecho bien documentado es que los embriones somáticos se multiplican por embriogénesis secundaria y esto se genera como un proceso recurrente. Generalmente en guayaba, la capacidad de multiplicación por medio de la embriogénesis recurrente es muy elevada, aparentemente ilimitada en el tiempo e independiente de las condiciones ambientales (Celestino et al., 2005; Vilchez, 2016; Martin 2017).
Por otro lado, la asincronía que caracteriza a los cultivos embriogénicos, se considera la principal desventaja de la embriogénesis somática, sobre todo cuando pretende ser utilizada para la propagación masiva de plantas (García-Águila et al., 2016). Sin embargo, cuando se compara la embriogénesis somática primaria con la embriogénesis secundaria, esta última presenta la ventaja de generar un alto coeficiente de multiplicación independientemente de la fuente de explante y además, permite que la embriogénesis somática pueda ser mantenida por periodos de tiempo prolongados mediante ciclos repetitivos de embriogénesis secundaria (Raemakers et al., 1995).
Con el objetivo de lograr la sincronía o estabilidad de los embriones somáticos, Yantcheva et al. (1998) señalaron que una vez obtenidos los cultivos de células aisladas o pequeños agregados, se hace necesario mantener un desarrollo embriogénico estable, sin aparición de embriogénesis secundaria. Para ello, sugieren la utilización de sustancias que disminuyan el potencial osmótico del medio de cultivo y que no tengan poder de penetración celular como el polietilenglicol (PEG), que por su alto peso molecular permite la estabilización del proceso embriogénico.
Desarrollo y maduración de embriones somáticos
Una vez lograda la embriogénesis somática, los embriones somáticos entran en un proceso cíclico de clonación embriónica, que no requieren en la mayoría de los casos, la presencia de reguladores del crecimiento. De esta manera, para lograr el desarrollo de embriones somáticos, es necesario transferir los cultivos embriogénicos a medio de cultivo carente de auxina (von Arnold et al., 2002).
La investigación de Rai et al. (2007) informó que luego de mantener a los explantes (embriones cigóticos inmaduros) durante 8 días en contacto con la auxina (2,4-D), los transfirieron a medio de cultivo libre de reguladores del crecimiento. Los resultados mostraron el desarrollo de embriones somáticos en etapa globular a los 16 días del cultivo y al final de la cuarta semana, se presentaron embriones en las etapas de globular, corazón y cotiledonal en toda la superficie del explante, a diferencia de los que se mantenían tratados con el 2,4-D, que no presentaron los estados de desarrollo antes mencionados. Resultados similares fueron informados por Martin (2017) donde los explantes que estuvieron expuesto durante 10 días a las diferentes concentraciones de 2,4-D, durante la segunda semana a partir del inicio del cultivo en ausencia de la auxina, mostraron los primeros embriones somáticos como pequeñas estructuras transparentes acuosas. Nuevos embriones somáticos seguían apareciendo en la tercera y cuarta semana, y los que se formaron anteriormente, aumentaron su tamaño y siguieron la ruta de desarrollo embriogénico hacia el estado globular y corazón.
En la fase desarrollo y maduración de los embriones somáticos, también se ha referido que el uso de otro tipo de azúcares tales como maltosa (Reidiboym et al., 1998) y fructosa (Merkle y Battle, 2000) pueden tener una influencia significativa, al igual que la presencia de caseína hidrolizada (Yantcheva et al., 1998). Todas estas sustancias pueden ser determinantes en esta fase del proceso de embriogénesis somática, en la cual se confiere a las “semillas somáticas” la capacidad de almacenamiento de sustancias de reserva y resistencia a la desecación.
De la misma manera, la investigación de Rai et al. (2009) señaló que para lograr la maduración de los embriones somáticos, el tejido embriogénico fue transferido a medio de cultivo que contenía diferentes concentraciones de sacarosa, ácido abscísico (ABA) y dos aminoácidos: L-glutamina y L-prolina. De las diferentes concentraciones de sacarosa utilizadas, 5% fue la más efectiva para la maduración de embriones somáticos, así como también, sugirieron la adición de ABA y L-prolina al medio de cultivo de crecimiento libre de auxina, para mejorar la eficiencia en la maduración de los embriones somáticos.
Sistemas de inmersión temporal (SIT)
El desarrollo y aplicación de protocolos basados en el uso de medios de cultivo líquido en algunas o todas las fases de la propagación in vitro puede reducir considerablemente los costos y la manipulación del material vegetal (Teisson y Alvard, 1999; De Feria et al., 2003). En este sentido, los sistemas de inmersión temporal constituyen una tecnología que ha permitido la automatización de algunas etapas del cultivo in vitro, permiten mayor facilidad en el manejo de los cultivos, su inoculación y colecta, con lo cual se ahorra tiempo y mano de obra durante el proceso (Etienne y Berthouly, 2002).
Se ha demostrado la posibilidad de regular el progreso en medio de cultivo líquido de embriones somáticos de diferentes especies, entre ellas la guayaba en sistemas de inmersión temporal. Su uso permite sincronizar el desarrollo de los embriones somáticos e impide la aparición de embriogénesis secundaria así como estimula la maduración (Vilchez et al., 2001; Etienne y Berthouly, 2002).
Además, los SIT se han empleado en el cultivo in vitro de guayaba por organogénesis. de Feria et al. (2003) valoraron el efecto de la frecuencia de inmersión y la densidad de inóculo en la multiplicación in vitro de guayaba en sistemas de inmersión temporal. Los resultados confirmaron la importancia de los parámetros de cultivo como la frecuencia de inmersión y la densidad de inoculación en la multiplicación in vitro de guayaba. Se demostró, además, que la aplicación de ventilación de manera forzada al recipiente de cultivo reduce las afectaciones de los explantes por hiperhidricidad y favorece la posterior aclimatización en condiciones ex vitro de las plantas producidas in vitro.
Por su parte, Vilchez y Albany (2014) con el propósito de generar una metodología que permitiera disminuir costos de producción (por la exclusión del agente gelificante en los medios de cultivo), evaluaron el uso de SIT en la fase de multiplicación in vitro de guayaba cv. ‘Enana Roja Cubana EEA-1840’. Se determinó que el empleo de SIT tipo RITA® con 3 o 4 inmersiones al día con 2 min de duración mejoró el coeficiente de multiplicación de los microesquejes.
Germinación de embriones somáticos y conversión en planta
Freire (2003) refirió que en la mayoría de los trabajos realizados se hace poca distinción entre los procesos de germinación y conversión y no se tiene en cuenta que la germinación solo se refiere al desarrollo de la raíz y el brote. La germinación de los embriones somáticos y su crecimiento para la regeneración en planta, depende de las condiciones previstas de las fases anteriores.
La investigación de Jiménez (2005) señaló que en algunos casos, los embriones somáticos germinan en medio de cultivo sin reguladores de crecimiento, mientras que hay otros donde la presencia de auxinas o citoquininas estimula la germinación. En el caso de guayaba, algunos investigadores han informado que la reducción en las concentraciones de auxina y sacarosa, se hace necesaria para lograr con éxito la germinación de los embriones somáticos, así como también, se requiere reducir las sales del medio de cultivo (MS) a la mitad de su concentración (Rai et al., 2007; Rai et al., 2010; Kamle et al., 2011).
Por otro lado, el uso de BAP (0.5 mg l-1), ANA (0.1 mg l-1) y sacarosa (3%) han resultado convenientes para lograr el porcentaje máximo de conversión (42.5%) de los embriones somáticos a plántulas (Kamle et al., 2012). Además de esto, la combinación de ácido abscísico con la sacarosa también demostraron ser efectivos en la germinación y conversión en plantas de embriones somáticos en guayaba del cultivar ‘Banarasi local’ (Rai et al., 2007; Rai et al 2010b).
En este sentido, Vilchez et al. (2001) con la finalidad de estudiar la germinación de embriones somáticos de guayaba cv. ‘EEA 18-40’ en sistemas de inmersión temporal, cultivaron embriones somáticos en etapa corazón y torpedo en medio de cultivo MS al 50% de las sales mayores. Como control utilizaron medio de cultivo semisólido de igual composición al utilizado en los SIT. Se evaluaron las variables porcentaje de germinación y masa fresca. Después de diez semanas de cultivo los mayores valores del porcentaje de germinación (91.04%) y masa fresca (1.22 g) se obtuvieron en los SIT, siendo estos significativamente diferentes a los obtenidos en medio de cultivo semisólido (9.79% y 1.03 g, respectivamente).
Otras investigaciones señalan la importancia que tiene la germinación de los embriones somáticos, en cuanto a la precocidad con que se lleva a cabo este proceso (von Arnold et al., 2002; Jiménez, 2005; Rai et al., 2010a). Por lo tanto, con el fin de producir plantas a partir de embriones somáticos, se requiere un análisis de los factores críticos que podrían contribuir a la germinación (Rai et al., 2007).
Ante las consideraciones anteriores, Gómez et al. (2005) recomendaron el uso de medio de cultivo líquido con la adición de BAP y Biobras-6 para lograr la germinación de embriones somáticos. De la misma manera, Concepción et al. (2008) sugirieron el cultivo de callos en medio de cultivo líquido para obtener una embriogénesis somática de alta frecuencia y para que los embriones somáticos mostraran capacidad para lograr la germinación y la conversión in vitro.
Así mismo, Vilchez et al. (2001) informaron que para lograr la mayor eficiencia en la germinación de los embriones somáticos de guayaba, el empleo de sistemas de inmersión temporal es una alternativa viable, con los cuales, además, se puede lograr una mayor sincronización. Igualmente, Vilchez (2016) determinó que la germinación de embriones somáticos en sistema de inmersión temporal fue superior en comparación con el medio de cultivo semisólido.
Por otro lado, la conversión en planta es definida como el desarrollo del brote con emisión del primer par de hojas verdaderas (Stuart y Strickland, 1984). Otros autores la definen como la supervivencia del propágulo en condiciones ambientales ex vitro (Alemano et al., 1997).
Se ha informado que los embriones somáticos de especies de la familia Myrtaceae germinan bien en medios de cultivo simples, a la mitad de las sales y sin reguladores del crecimiento (Litz, 1984; Parra y Amo-Marco, 1998). También se ha señalado que la sincronización en la germinación se mejora cuando se da un subcultivo a los embriones somáticos a medio de cultivo con de 20% sacarosa (Canhoto et al., 1999).
Para mejorar las tasas de conversión, se considera importante tener en cuenta el momento de la transferencia ex vitro, dado que en algunas especies se ha observado que la transferencia de los embriones recién germinados, pueden proporcionar mejores tasas que las de plantas inicialmente desarrolladas in vitro (Celestino et al., 2005).
CONSIDERACIONES FINALES
La embriogénesis somática se está considerando como la vía de regeneración más eficiente para la propagación in vitro de guayaba, debido a los altos coeficientes de multiplicación en cortos períodos de tiempo y a la posibilidad de automatizar todo el proceso productivo. Además, se presenta como una técnica biotecnológica que puede impactar significativamente como herramienta complementaria a las técnicas convencionales de mejoramiento genético, ya que su inclusión en dichos programas, permitiría incrementar la eficiencia en la propagación, la conservación y el desarrollo de nuevas variedades.
Por otro lado, la estandarización de protocolos para la embriogénesis somática en guayaba, se considera fundamental para los procesos de propagación in vitro, ya que los avances han demostrado que cada cultivar requiere condiciones específicas para su establecimiento. Por lo tanto, se hace conveniente seguir adecuando las metodologías a fin de generar protocolos más eficientes, orientados hacia la propagación masiva de los cultivares de interés económico.
A la fecha no hay informes sobre la producción a gran escala de guayaba por técnicas biotecnológicas, aunque se ha avanzado en el perfeccionamiento de los protocolos, se ha revelado que algunos tratamientos, que coinciden con un mayor rendimiento de embriones somáticos, pueden causar efectos adversos en su calidad, lo que incide directamente en el establecimiento a condiciones ex vitro. Por lo tanto, el éxito de la conversión en planta, está determinada por una influencia acumulativa de los tratamientos aplicados durante el período in vitro. En este sentido, para lograr una propagación in vitroeficiente, es importante entender cómo se desarrollan los embriones somáticos, y cómo este se ve influenciado por los diferentes tratamientos físicos y químicos aplicados en las fases anteriores.
REFERENCIAS
Akhtar N (2013a) Endogenous Polyamines: A Temporal Cellular Modulator of Somatic Embryogenesis in Guava (Psidium guajava L.) cv. Allahabad Safeda. Research in Plant Sciences 1(2):4-14; doi:10.12691/plant-1-2-1
Akhtar N (2010) Evaluation of the efficiency of somatic embryogenesis in guava (Psidium guajava L.). Journal of Horticultural Science & Biotechnology 85(6): 556-562; doi:10.1080/14620316.2010.11512714
Akhtar N (2013b) Temporal regulation of somatic embryogenesis in guava (Psidium guajava L.). The Journal of Horticultural Science and Biotechnology 88(1): 93-102; doi:10.1080/14620316.2013. 11512941
Akhtar N, Kumari N, Pandey S, Ara H, Singh M, Jaiswal U, Jaiswal V, Jain S (2000) Somatic embryogenesis in tropical fruit trees. Somatic embryogenesis in woody plants 6: 93-131; doi:10.1007/978-94-017-3030-3_4
Alemano L, Berthouly M, Michaux-Ferreiere N (1997) EmbryogenÃÃÂèses somatique du cacaoyer a partir de piÃÃÂèces florales. Plantations, Recherche, Développement 3(4): 225-237
Biswas B, Joshee N, Yadav A, Yadav AK (2007) Development and application of biotechnology in Guava: a nutraceutical fruit. International Society Horticultural Science 744: 267-276; doi:10.17660/ActaHortic.2007.744.28
Canhoto J, Lopes M, Cruz G (1999) Somatic embryogenesis and plant regeneration in myrtle (Myrtus communis L.). Plant Cell, Tissue and Organ Culture 57:13-21; doi:10.1023/A1006273128228
Capote A, Pérez N, Pérez A, Wilken D, Gerth A, Müller A, Jiménez E (2009) Efecto del cultivo in vitro en el perfil metabólico de Psidium guajava L.. Biotecnología Vegetal 9(1): 41-45
Celestino C, Hernández I, Carneros E, López D, Toribio M (2005) La embriogénesis somática como elemento central de la biotecnología forestal. Invest Agrar Sist Recur For 14(3): 345-357; doi:10.5424/srf/2005143-00925
Chandra R, Bajpai A, Gupta S, Tiwari R (2004) Embryogenesis and plant regeneration from mesocarp of Psidium guajava L (guava). Indian Journal of Biotechnology 3(2): 246-248
Concepción O (2008) Organogénesis y embriogénesis somática in vitro en el guayabo (Psidium guajava L.) cv. Enana Roja Cubana. Tesis en opción al Grado Científico de Doctor en Ciencias Agrícolas, Universidad de Ciego de Ávila, Ciego de Ávila, Cuba
De Feria M, Chávez M, Quiala E, Jiménez E (2003) Efecto de la densidad de inóculo y la frecuencia de inmersión en la propagación in vitro de Psidium guajava cv. Enana roja en sistemas de inmersión temporal. Biotecnología Vegetal 3(3): 149 – 154
Etienne H, Berthouly M (2002) Temporary immersion systems in plant micropropagation. Plant Cell, Tissue and Organ Culture 69(3): 215-231; doi:10.1023/A1015668610465
Fernández E, Pérez L (2015) Mejoramiento genético de guayabo (Psidium guajava L.). Cultivos Tropicales 36 (1): 96-110
Ferreira E, Yoshimitsu S (2009) Induction of somatic embryogenesis in immature seeds of guava tree cv. Paluma. Revista Brasileira de Fruticultura 31(2): 507-511; doi:10.1590/S0100-29452009000200027
Freire M (2003) Aspectos básicos de la embriogénesis somática. Biotecnología Vegetal 3(4): 195-209
Gamborg O, Miller R, Ojima K (1968) Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research 50(1): 151-158; doi:10.1016/0014-4827(68)90403-5
García-Águila L, Gómez R, Alvarado-Capó Y, Sarría Z, Albany N, Vilchez J, Reyes M, Pérez B, Rodríguez C (2016) Efecto de la densidad de inoculación de embriones somáticos en la obtención de plántulas de plátano cv. ‘FHIA-21’ (AAAB). Cultivos Tropicales 37(1): 57-64; doi:10.13140/RG.2.1.2456.5366
Gibson S (2000) Plant sugar-response pathways. Part of a complex regulatory web. Plant Physiology 124(4): 1532-1539; doi:10.1104/pp.124.4.1532
Gómez R, Vilchez J, Valero N, Peñalver D (2005) Somatic embryo germination of Psidium guajava L. in the Rita – temporary immersion system, on semisolid medium. En: Hvoslef A, Preil W (eds). Liquid Culture Systems for in vitro Plant Propagation, pp. 225-229. Springer-Verlag, Ahrensburg; doi:10.1007/1-4020-3200-5
Jaiswal U, Jaiswal V (2005) Psidium guajava guava. En: Litz, R (ed) Biotechnology of fruit and nut crops, pp 394-401, CAB International, Wallingford; doi:10.1079/9780851996622.0404
Jiménez V (2005) Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis. Plant Growth Regulation 47(2-3): 91-110; doi:10.1007/s10725-005-3478-x
Kamle M, Bajpai A, Chandra R, Kalim S, Kumar R (2011) Somatic embryogenesis for crop improvement. GERF Bulletin of Biosciences 2(1): 54-59
Kamle M, Kalim S, Bajpai A, Chandra R, Kumar R (2012) In vitro Selection for Wilt Resistance in Guava (Psidium guajava L.) cv. Allahabad Safeda. Biotechnology 11(3): 163- 171; doi:10.3923/biotech. 2012.163.171
Kamle M, Bajpai A, Kalim S, Chandra R (2016) Recurrent somatic embryogenesis and plantlet regeneration in Psidium guajava L. Braz Arch Bio Technol 59: e16150170; doi:10.1590/1678-4324-2016150170
Kessel A (2008) Aplicación de técnicas biotecnológicas en frutales, una vía valiosa para el rescate y la conservación de estas especies. Cultivos Tropicales 29(3): 27-37
Laffitte O, Borrero L, Martínez A, Ballbé N, Sánchez R (2004) Regeneración de brotes adventicios en hojas de guayaba (Psidium guajava L.) cultivadas in vitro. Revista Colombiana de Biotecnología 6(2): 54-61
Litz R (1984) In vitro somatic embryogenesis from callus of Jaboticaba, Myrciaria cauliflora. HortScience 19(1): 62-64
Lozano J, Toro J, García R, Tafur R (2002) Manual sobre el cultivo del guayabo en Colombia. Corporación Autónoma Regional del Valle del Cauca, Cali; ISBN: 9583391255
Martin D (2017) Embriogénesis somática como herramienta para la propagación de guayaba (Psidium guajava L.). Tesis doctoral Escuela Socialista de Agricultura Tropical, Instituto Nacional de Investigaciones Agrícolas, Maracay, Venezuela
Merkle S, Battle P (2000) Enhancement of embryogenic culture initiation from tissues of mature sweetgum trees. Plant Cell Reports 19(3): 268-273; doi:10.1007/s002990050010
MPPAT – Ministerio del Poder Popular para la Agricultura y Tierras (2011) Manual del cultivo de la guayaba. Ediciones FONDAS, Caracas; ISBN: 978-980-219-084-3
Murashige T, Skoog F (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15(3): 473-497; doi:10.1111/j.1399-3054.1962.tb08052.x
Ocampo F, Núñez V (2007) Propagación in vitro de Psidium guajava mediante organogénesis directa a partir de segmentos nodales. Ciencia y Tecnología Agropecuaria 18(1): 22-27
Parra R, Amo-Marco J (1998) Secondary somatic embryogenesis and plant regeneration in myrtle (Myrtus communis L.). Plant Cell Reports 18(3-4): 325-330; doi:10.1007/s002990050580
Patel R, Maiti C, Deka B, Vermav V, Deshmukh N, Verma M (2015) Genetic Variability, Character Association and Path Coefficient Study in Guava (Psidium guajava L.) for Plant growth, Floral and Yield Attributes. International Journal of Bio-resource and Stress Management 6(4): 457-466; doi:10.5958/0976-4038.2015.00068.8
Raemakers C, Jacobsen E, Visser R (1995) Secondary somatic embryogenesis and applications in plant breeding. Euphytica 81(1): 93-107; doi:10.1007/BF00022463
Rai M, Akhtar N, Jaiswal V (2007) Somatic embryogenesis and plant regeneration in Psidium guajava L. cv. Banarasi local. Scientia Horticulturae 113(2): 129-133; doi:10.1016/j.scienta.2007.02.010
Rai M, Asthana P, Jaiswal V, Jaiswal U (2010a) Biotechnological advances in guava (Psidium guajava L.): recent developments and prospects for further research. Trees 24(1): 1-12; doi:10.1007/s00468-009-0384-2
Rai M, Jaiswal V, Jaiswal U (2009) Shoot multiplication and plant regeneration of guava (Psidium guajava L.) from nodal explants of in vitro raised plantlets. Journal of Fruit and Ornamental Plant Research 17(1): 29-38
Rai M, Jaiswal V, Jaiswal U (2010b) Regeneration of plantlets of guava (Psidium guajava L.) from somatic embryos developed under salt-stress condition. Acta Physiologiae Plantarum 32(6): 1055–1062; doi:10.1007/s11738-010-0496-8
Ramírez M, Salazar E (1998) Cultivo in vitro de embriones inmaduros del guayabo (Psidium guajava L.). Revista de la Facultad de Agronomía (LUZ) 15(3): 211-221
Reidiboym L, Diemer F, Sourdioux M, Chapelain K, De March G (1998) Improvement of somatic embryogenesis in wild cherry (Prunus avium): Effect of maltose and ABA supplements. Plant cell, tissue and organ culture 55(3): 199-209; doi:10.1023/A1006239009801
Reinert J (1959) Über die der Kontrolle Morphogenese und die Induktion von Adventivembryonen un Gewebekulturen aus Karotten. Planta 53 (4): 318-333; doi:10.1007/BF01881795
Sharp W, Sondahl M, Caldas L, Maraffa S (1980) The physiology of in vitro asexual embryogenesis. Hortic Rev 2: 268-310; doi:10.1002/9781118060759.ch6
Singh G, Tiwari J, Lal S (2007) In vitro callus induction in guava (Psidium guajava l.). Acta Hortic 735:139-143; doi:10.17660/ActaHortic.2007.735.18
Steward F, Mapes M, Mears K (1958) Growth and organized development of cultured cells. II. Organization in cultures grown from freely suspended cells. American Journal of Botany 45(10): 705-708; doi:10.2307/2439728
Stuart D, Strickland S (1984) Embryogenesis from cell cultures of Medicago sativa. The role of aminoacid additions to the regeneration medium. Plant Science Letters 34:74-81
Tariq S, Roshan Z, Ahmad J, Haidar A, Lutfullah G (2008) In vitro regeneration of plantlets from seedlings explants of guava (Psidium guajava L.) cv. Safeda. Pakistan Journal of Botany 40(3): 1195-1200
Teisson C, Alvard D (1999) In vitro production of potato microtubers in liquid medium using temporay immersion. Potato Research 42(3-4): 499–504; doi:10.1007/BF02358166
Tisserat B, Esan E, Murashige T (1979) Somatic embryogenesis in angiosperms. Hort Rev 1: 1-78
Vilchez J, Albany N (2014) Multiplicación in vitro de Psidium guajava L. en sistemas de inmersión temporal. Revista Colombiana de Biotecnología XVI (2): 96-103
Vilchez J, Albany N, Gómez R, García L (2002) Inducción de embriogénesis somática en Psidium guajava L., a partir de embriones cigóticos. Revista Facultad de Agronomía 19: 284-293
Vilchez J (2016) Embriogénesis Somática en Guayabo (Psidium guajava L.). Tesis doctoral, Universidad de Córdoba – Universidad del Zulia (doctorado en conjunto), Maracaibo, Venezuela
Vilchez J, Valero N, Gómez R, García L, Agramonte D (2001) Germinación de embriones somáticos de Psidium guajava L. cv. Enana Roja Cubana EEA 18-40 en sistemas de inmersión temporal. Biotecnología Vegetal 2(2):67-69
von Arnold S, Sabala I, Bozhkov P, Dyachok J, Filonova L (2002) Developmental pathways of somatic embryogenesis. Plant Cell, Tissue and Organ Culture 69(3): 233-249; doi:10.1023/A1015673200621
Yantcheva A, Vlahova M., Antanassov A (1998) Direct somatic embryogenesis and plant regeneration of carnation (Dianthus caryophyllus L.). Plant Cell Reports 18(1-2): 148-153; doi:10.1007/s002990050548
Martin, D. (2017). Embriogénesis somática: una herramienta biotecnológica para la propagación in vitro de guayaba.Biotecnología Vegetal, 17(4). Recuperado de https://revista.ibp.co.cu/index.php/BV/article/view/563/html
