Tema 2: Disoluciones
Tipos de soluciones y solubilidad

Desde nuestra experiencia sabemos que el azúcar y la sal de mesa son solubles en agua (por razones diferentes, la primera por tener fuerzas intermoleculares equivalentes y la segunda por presentar fuerzas ión-dipolo). Sin embargo, no podemos disolver un kilo de sal en un vaso de agua: hay una cantidad de soluto que se puede disolver, pero pasada esta cantidad el soluto ya no se disuelve y se va al fondo del vaso, por más que agitemos vigorosamente. La experiencia también nos dice que el azúcar o sal se disuelven mejor si calentamos el agua, pero aún así hay un límite en la cantidad de soluto que se puede disolver.
La cantidad de soluto que es posible disolver en un solvente dependerá de la naturaleza de éstos y de la temperatura a la que se realice la disolución.
Observen en el video, te ayudará a comprender la naturaleza de los diferentes tipos de soluciones:
Las soluciones pueden ser diluídas o concentradas:
|
Diluídas: |
Son aquellas en las que hay muy poca cantidad de soluto disuelto, el solvente puede seguir admitiendo más soluto. Un ejemplo es la cantidad de minerales en el agua de mesa: tiene una cantidas muy baja que nos permite asimilarlos correctamente. |
| Concentradas: |
Son aquellas en las que hay bastante cantidad de soluto disuelto, pero el solvente todavía puede seguir admitiendo más soluto. Un ejemplo podría ser el agua de mar: contiene una gran cantidad de sal disuelta, pero todavía sería posible disolver más cantidad de sal. |
 |
Ejercicio 6.1: Sobre soluciones diluídas y concentradas Para el siguiente par de soluciones, señala cuál corresponde a una solución diluída. Solución A: 200 mL de solución que contiene 125 mL de etanol (d= 0,8 g/mL) mezclados con agua. Solución B: 300 mL de solución que contiene 64 g de etanol mezclados con agua. |
|
Lo primero que hay que determinar es la cantidad de gramos de soluto en cada solución. Y después compararlas en base a un mismo volumen. Para la solución A: Debes determinar la cantidad en gramos de etanol presente en los 125 mL, ten encuenta el valor de la densidad del etanol. De esa manera conoceras la cantidad de gramos de etanol que hay en 200 mL de la solución. Respuesta: 125 mL (0,8 g/mL) = 100 g de etanol en 200 mL, lo cual equivale a 0,5g de etanol por cada mL de solución. Para la solución B: 64 g de etanol en 300 mL de solución, equivale a decir que tenemos 0,213 g de etanol por cada mL de solución. Ahora pueden comparar y concluir que la solución B será más diluida que la solución A, pues tiene menos soluto disuelto en una misma cantidad de solución |
|
En función a la cantidad de soluto disuelto, las soluciones se pueden clasificar en saturadas, insaturadas o sobresaturadas:
| Saturadas: |
Son aquellas en las que no se puede seguir admitiendo más soluto, pues el solvente ya no lo puede disolver. Si la temperatura aumenta, la capacidad para admitir más soluto aumenta. Lo podemos asociar con el aforo de un cine: si una sala tiene capacidad para 100 personas, éste es el máximo número de personas que podrán entrar. De igual forma, una solución saturada es aquella en la que se ha disuelto la máxima cantidad de gramos de soluto que el solvente puede acoger. |
| Sobresaturadas: | Son aquellas en las que se ha añadido más soluto del que puede ser disuelto en el solvente, por tal motivo, se observa que una parte del soluto va al fondo del recipiente. La solución que observamos está saturada (contiene la máxima cantidad de soluto disuelto), y el exceso se va al fondo del recipiente. La capacidad de disolver el soluto en exceso aumenta con la temperatura: si calentamos la solución, es posible disolver todo el soluto. |
Se tendrá una solución insaturada cuando hemos disuelto una cantidad de soluto menor a la cantidad máxima que podemos disolver. Ten presente que la cantidad máxima de soluto que podemos disolver en un determinado solvente es un dato que nos proporcionarán.
Solubilidad
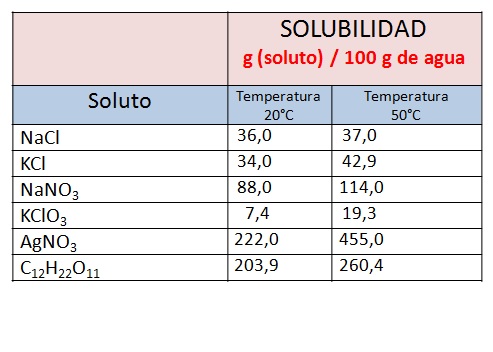
La temperatura tiene un efecto directo sobre la solubilidad de un soluto en un solvente. La cantidad de soluto necesaria para formar una solución saturada en una cantidad dada de solvente se conoce como la solubidad máxima de ese soluto.
 |
Si tenemos la siguiente información: Ésta es la cantidad máxima de NaCl que se puede disolver en agua, para dar una solución saturada a esa temperatura. ¿Se podrá agregar más NaCl a esa solución? Sí, pero solo hasta alcanzar los 36 g de NaCl en total. Si nos pasamos esta cantidad el soluto ya no se podrá disolver y estaremos frente a una solución sobresaturada. |
| A continuación se muestra una tabla con los límites de solubilidad de algunas sustancias en agua a dos temperaturas distintas. Observa que la cantidad de soluto que podemos disolver es mayor cuando la temperatura del solvente es mayor. | |
 |
|
 |
Ejercicio 6.2
|
